MEKANISME REAKSI ELIMINASI PADA ALKIL HALIDA DAN ALKOHOL
Pengantar
Dalam reaksi eliminasi, suatu molekul kehilangan/melepaskan atom atau ion-ion dari strukturnya. Senyawa organik yang mengalami reaksi eliminasi ini misalnya alkil halida, akan berubah menjadi suatu alkena. Pada reaksi ini, unsur H dan X keluar dari senyawa alkil halida, karenanya reaksi eliminasi alkil halida sering juga disebut dengan reaksi dehidrohalogenasi (Fessenden dan Fessenden, 1982).
Ada juga reaksi lepasnya H dan OH dari suatu alkohol, sering disebut dengan reaksi dehidrasi, lalu ada lagi reaksi keluarnya dua H dari suatu senyawa organik, sering disebut reaksi dehidrogenasi.
Pengertian
Reaksi eliminasi adalah salah satu jenis reaksi organik di mana dua substituen dipisahkan dari suatu molekul baik dalam mekanisme satu atau dua-tahap.Mekanisme satu-tahap dikenal sebagai reaksi E2, dan mekanisme dua-tahap dikenal sebagai reaksi E1.
mekanisme E2 merupakan singkatan dari eliminasi bimolekular. Reaksi tersebut melibatkan mekanisme satu-tahap di mana ikatan karbon-hidrogen dan karbon-halogen terputus untuk membentuk ikatan rangkap dua (ikatan pi C=C).
Karakteristik mekanisme reaksi ini transisi.
EXAMPLE :
Aturan Zaitsev
Faktor yang mempengaruhi reaksi yang mengacu pada aturan zaitsev adalah Efek sterik dan Streokimia
Simpulan :
PERMASALAHAN
Dalam reaksi eliminasi, suatu molekul kehilangan/melepaskan atom atau ion-ion dari strukturnya. Senyawa organik yang mengalami reaksi eliminasi ini misalnya alkil halida, akan berubah menjadi suatu alkena. Pada reaksi ini, unsur H dan X keluar dari senyawa alkil halida, karenanya reaksi eliminasi alkil halida sering juga disebut dengan reaksi dehidrohalogenasi (Fessenden dan Fessenden, 1982).
Ada juga reaksi lepasnya H dan OH dari suatu alkohol, sering disebut dengan reaksi dehidrasi, lalu ada lagi reaksi keluarnya dua H dari suatu senyawa organik, sering disebut reaksi dehidrogenasi.
Reaksi eliminasi dibagi menjadi dua yaitu reaksi E1 dan reaksi E2. Maksud simbol E adalah inisial dari Eliminasi, sedangkan angka di belakangnya menunjukkan reaksi tersebut unimolekuler (1) atau bimolekuler (2).
Reaksi E1 laju reaksinya bergantung oleh konsentrasi substrat saja, sedangkan pada E2, laju reaksinya bergantung pada konsentrasi substrat dan juga konsentrasi agen pengeliminasi.
Reaksi eliminasi adalah salah satu jenis reaksi organik di mana dua substituen dipisahkan dari suatu molekul baik dalam mekanisme satu atau dua-tahap.Mekanisme satu-tahap dikenal sebagai reaksi E2, dan mekanisme dua-tahap dikenal sebagai reaksi E1.
Mekanisme E2
Reaksi E2 adalah proses satu tahap. Nukleofil bertindak sebagai basa dan
mengambil proton (hidrogen) dari atom karbon yang bersebelahan dengan karbon
pembawa gugus pergi. Pada waktu yang bersamaan, gugus pergi terlepas dan ikatan rangkap dua terbentuk.
mekanisme E2 merupakan singkatan dari eliminasi bimolekular. Reaksi tersebut melibatkan mekanisme satu-tahap di mana ikatan karbon-hidrogen dan karbon-halogen terputus untuk membentuk ikatan rangkap dua (ikatan pi C=C).
Reaksi E2 berjalan tidak melalui suatu karbokation dahulu sebagai zat antara, melainkan berupa reaksi serentak. Reaksi serentak ini maksudnya suatu reaksi yang terjadi sekaligus pada satu tahap. Reaksi yang terjadi pada E2 diantaranya :
- Basa membentuk ikatan dengan hidrogen
- Elektron-elektron C-H membentuk ikatan pi
- Halida bersama sepasang elektronnya meninggalkan ikatan sigma C-X
Mekanisme reaksi E2 lebih jelasnya bisa perhatikan gambar berikut :
Basa yang digunakan untuk melangsungkan reaksi E2 adalah basa kuat.
Karakteristik mekanisme reaksi ini transisi.
- Biasanya terjadi pada alkil halida primer tersubstitusi, namun mungkin terjadi pada alkil halida sekunder dan senyawa lainnya.
- Laju reaksinya mengikuti orde kedua, karena reaksi dipengaruhi baik oleh alkil halida dan basa (bimolekular).
- Karena mekanisme E2 menghasilkan pembentukan ikatan pi, dua gugus pergi (terkadang sebuah hidrogen dan suatu halogen) harus antiperiplanar. Keadaan transisi antiperiplanar memiliki konformasi goyang (staggered) dengan energi yang lebih rendah dibanding keadaan transisi sinperiplanar di mana konformasi eklips dengan energi yang lebih tinggi. Mekanisme reaksi yang melibatkan konformasi goyang lebih disukai pada reaksi E2 (tidak seperti reaksi E1).
- E2 biasanya menggunakan basa kuat. Basa harus cukup kuat untuk melepas hidrogen yang kurang asam.
- Agar ikatan pi dapat terbentuk, hibridisasi karbon harus lebih rendah dari sp3 menjadi sp2.
- Ikatan C-H dilemahkan dalam tahap penentu laju dan karenanya efek isotop deuterium primer lebih besar dari 1 (biasanya 2-6) teramati.
- E2 berkompetisi dengan mekanisme reaksi SN2 jika basa dapat bertindak pula sebagai nukleofil (pada banyak basa yang umum).
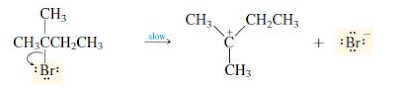
Mekanisme E1
Mekanisme E1 mempunyai tahap awal yang sama dengan mekanisme SN1. Tahap lambat atau penentuan ialah tahap ionisasi dari substrat yang menghasilkan ion
karbonium
E1 merupakan reaksi eliminasi unimolekuler. Mekanisme E1 mempunyai tahap awal yang sama dengan mekanisme SN1. E1 terdiri dari dua langkah mekanisme yaitu ionisasi dan deprotonasi. Ionisasi adalah putusnya ikatan hidrogen-halogen membentuk intermediet karbokation. Reaksi E1 biasanya terjadi pada alkil halida tersier. Reaksi ini berlangsung tanpa kuat, melainkan dengan basa lemah (dalam suasana asam dan suhu tinggi). Reaksi E1 mirip dengan reaksi SN1, karna sama sama menggunakan reaksi intermediet karbokation. Tahap lambat atau penentuan ialah tahap ionisasi dari substrat yang menghasilkan ion karbonium.
Berikut mekanisme reaksi pada E1 :
1. Tahap 1 reaksi E1 berjalan lambat, terjadi pemisahan gugus pergi dari substrat yang menghasilkan senyawa antara karbokation
2. Tahap 2 reaksi E1 berjalan cepat, meliputi pengeluaran proton oleh suatu basa
3. dan pembentukan ikatan rangkap
EXAMPLE :
Aturan Zaitsev
Aturan Zaitsev merupakan suatu aturan empiris untuk menentukan produk alkena mana yang lebih disukai dari suatu reaksi eliminasi. Zaitsev mengemukakan bahwa "Alkena terbentuk dengan jumlah lebih besar pada salah satu yang sesuai dengan lepasnya hidrogen di β-carbon yang memiliki jumlah substituen hidrogen lebih sedikit" artinya adalah produk mayor alkena akan berada pada β-carbon yang substituen hidrogennya lebih sedikit.
EXAMPLE :
Misalnya anda mereaksikan 2-bromobutana dengan KOH, maka produk mayornya adalah 2-butena, sedangkan 1-butena sebagai produk minor.
Lihat gambar berikut :
Lihat gambar berikut :
Nama, Pada gambar tersebut, produk 2-butena lebih banyak. Karena β-carbon sekunder memiliki jumlah substituen hidrogen lebih sedikit daripada primer.
Faktor yang mempengaruhi reaksi yang mengacu pada aturan zaitsev adalah Efek sterik dan Streokimia
Simpulan :
PERMASALAHAN
1. Reaksi E1 biasanya terjadi pada alkil halida tersier, Bagaimana dengan halida sekunder ?
2. Bagaimana cara kita menentukan suatu reaksi menggunakan reaksi E1 atau E2?
3. Berdasarkan kutipan diatas dikatakan bahwa "Basa yang digunakan untuk melangsungkan reaksi E2 adalah basa kuat." Apakah bisa ketika menggunakan basa lemah ?
3. Berdasarkan kutipan diatas dikatakan bahwa "Basa yang digunakan untuk melangsungkan reaksi E2 adalah basa kuat." Apakah bisa ketika menggunakan basa lemah ?











Disini saya akan menjawab permasalahan nomor 1, dimana untuk reaksi Alkil halida primer dan sekunder akan mengalami reaksi E2 ( 1 tahap ). Konfigurasi yang terbaik untuk reaksi E2 adalah konfigurasi dimana hidrogen yang akan tereliminasi dalam posisi anti dengan gugus pergi. Alasannya ialah bahwa pada posisi tersebut orbital ikatan C-H dan C-X tersusun sempurna yang memudahkan pertumpang tindihan orbital dalam pembentukan ikatan baru ( ikatan phi , rangkap 2 alkena ).
BalasHapussaya akan menjawan permasalahan no.2
BalasHapus1. kestabilan ion karbonium yang terbentuk,
makin stabil ion karbonium, makin mudah terjadi E1
2. kekuatan basa,
makin kuat basa nya makin mudah terjadi E2
3. struktur RX
makin mudah x lepas, makin mudah terjadi E2 oleh faktor induksi dan faktor
crowded dan keasaman Hβ
Jawaban permasalahan no. 3. : Perlu diketahui bahwa, salah satu faktor yang mempengaruhi reaksi E1 dan E2 adalah tingkat kebasaanya. Semakin kuat basanya, maka akan semakin cepat jalannya reaksi, namun sebaliknya, semakin rendah tingkat kebasaan, maka semakin lambat reaksi yang berjalan, oleh karena itu, tentu saja bisa menggunakan basa lemah, namun reaksi yang berjalan akan sangat lambat.
BalasHapus